Завдання до екзамену з дисципліни " Неорганічна хімія"
(практичні)
1.Здійснити перетворення. Рівняння записати в іонному вигляді:
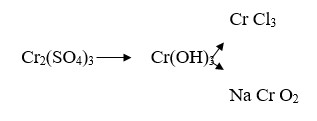
2.Чи відбудуться реакції у водному розчині між: Нітратом барію і сульфатом натрію; хлоридом амонію і сульфатом калію; гідроксидом заліза (ІІ) і оксидом міді (ІІ). Скласти рівняння у молекулярному і іонному вигляді.
3.Здійснити перехід карбонатів у гідрокарбонати та навпаки.
Дати схему балансу. Розставити коефіцієнти.
5.Скласти рівняння реакцій взаємодії міді з концентрованою та розведеною азотною кислотою. Дати схеми електронного балансу.
7. Як одержати аміак в лабораторії? Навести рівняння реакцій характеризуючи його властивості.
8.Навести рівняння одержання оксиду кальцію прожарювання мармуру та гідратація його.
10.Навести рівняння реакції одержання вуглекислого газу, які його властивості.
11.Скласти рівняння можливих реакцій в молекулярному та іонному вигляді,які відбуваються між попарно взятими розчинами: NaCl, Ba(NO3)2, K2SO4, AgNO3, Ba(OH)2,Na2CO3
12.З якими з перелічених речовин буде взаємодіяти соляна кислота: оксид магнію, оксид вуглецю (ІѴ), гідроксид кальцію, азотна кислота, сульфат цинку, гідроксид міді (ІІ)
13.Яке забарвлення буде мати лакмус у розчинах солей утворених:
а) слабкою основою та сильною кислотою;
б) сильною основою та слабкою кислотою;
14.Скласти рівняння реакцій у молекулярному та іонному вигляді які відбуваються між попарно розлитими розчинами: нітрата срібла, хлорида барію, фосфату натрію.
15.Чи відбувається реакція у водному розчині між: гідроксидом заліза(ІІІ) і соляною кислотою; залізом і сульфатом міді (ІІ); міддю і сульфатом залізі (ІІ); нітрату свинцю і сульфатом калію.
16. Скласти рівняння можливих реакцій у молекулярному та іонному вигляді між попарно злитими розчинами: NaCl, Ba(NO3)2, K2SO4, AgNO3, Ba(OH)2,Na2CO3 з утворенням не розчиненої солі.
17.Скласти рівняння гідролізу сульфатом міді, указати середовище, навести іонне рівняння.
18.Ряд напруги металів. Взаємодія металів з кислотами та солями.
19.Визначити тип зв'язку в молекулі:H2S, Al2O3, N2, навести схеми утворення цих молекул.
20.Навести по одному прикладу реакцій кожного з трьох випадків гідролізу солей.
23.З якими з перелічених речовин буде реагувати гідроксид калію: оксид вуглецю(ІѴ), хлорид заліза(ІІІ),гідроксид міді(ІІ),сірчана кислота, оксид цинку, оксид заліза(ІІ).
24.При зливанні розчинів соди і сульфату алюмінію утворився осад гідроксиду алюмінію. Пояснити це явище. Наведіть рівняння відповідних реакцій.
25.Одержати гідроксид цинку і доказати його амфотерні властивості. Рівняння записати у іонному вигляді.
26.Яке забарвлення буде мати фенолфталеїн в розчині сульфіду калію. Дайте ґрунтовну відповідь.
27.Скласти рівняння реакцій між речовинами які у водних розчинах взаємодіють за такими іонними схемами: